6. ¿Qué propiedad característica
presentan las moléculas que contienen carbonos asimétricos?
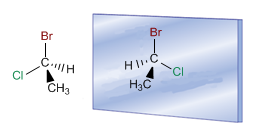
R:Compuestos con un carbono asimétrico, como puede ser el 2-clorobutano, pueden existir en forma de dos isómeros. El carbono 2 es asimétrico, se une a cuatro sustituyentes diferentes, que son: cloro, metilo, etilo e hidrógeno. La presencia del carbono asimétrico (centro quiral) permite la existencia de dos estereoisómeros (enantiómeros) que se diferencian por la diferente disposición espacial de los sustituyentes entorno al carbono asimétrico.
7. 7. ¿Cuáles son los monosacáridos más
pequeños que conoce?¿Cuáles son las principales diferencias entre ellos?R:Los monosacáridos son los carbohidratos más simples, ya que no pueden ser hidrolizados a los pequeños los hidratos de carbono. Ellos son aldehídos o cetonas con dos o más grupos hidroxilo. La fórmula química general de un monosacárido no modificado es (C • H2 O) n, literalmente, un "hidrato de carbono." Los monosacáridos son importantes moléculas de combustible, así como bloques de construcción para los ácidos nucleicos. El más pequeño monosacáridos, por lo que n = 3, se dihidroxiacetona y D-y L-gliceraldehído
R:
r
8. 8. ¿Por qué los dos isómeros ópticos de
una molécula que tiene un carbono asimétrico desvían en sentido diferente
(opuesto) el plano de la luz polarizada?R:Las moléculas de los isómeros ópticos son quirales , existen en dos formas, imágenes especulares, que no son superponibles Esta falta de simetría en las moléculas puede estar producida por varías causas, la más frecuente es que en ellas exista un estereocentro, en general un carbono unido a cuatro sustituyentes diferentes (carbono quiral).
9. 9. ¿Qué es una proyección de Fischer y
qué reglas se utilizan para desarrollarla?R:Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
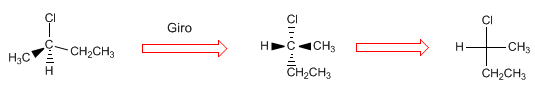
Aunque se acostumbra a dejar la cadena carbonada en la vertical, puede girarse la molécula de diferentes formas dando lugar a proyecciones de Fischer aparentemente diferentes, pero que en realidad representan la misma molécula.
Para comprobar que la proyección está bien hecha, vamos a dar notación R/S a la molécula y a su proyección.Para proyectar una molécula en Fischer es necesario dibujarla en la conformación eclipasada. Los sustituyentes que nos quedan en el plano van colocados arriba y abajo en la proyección. Los grupos que salen hacia nosotros (cuñas) se disponen a la derecha en la proyección, y los que van al fondo (lineas a trazos) se disponen a la izquierda.
10. 10. ¿Qué son enantiómeros?R:Los enantiómeros son imágenes especulares no superponibles. Se caracterizan por poseer un átomo unido a cuatro grupos distintos llamado asimétrico o quiral.
Ejemplo de enantiómeros: (R) y (S)-1-Bromo-1-cloroetano
En los modelos moleculares puede verse que las dos moléculas son distintas, no se superponen.
La presencia de un carbono asimétrico (con sustituyentes distintos: metilo, hidrógeno, cloro y bromo) hace posible que la molécula y su imagen especular sean distintas.¿Qué
comportamiento muestran frente a la luz polarizada?R:Los enantiómeros sólo difieren cuando interactúan con otras substancias o fenómenos quirales. Una forma sencilla en que puede observarse que los enantiómeros difieren es en su comportamiento respecto a la luzpolarizada plana. La luz polarizada plana tiene propiedades quirales. Cuando un rayo de luz polarizada plana pasa a través de un enantiómero el plano de polarización gira. Más aun, los enantiómeros separados hacen girar el plano de la luz en cantidades iguales pero en direcciones opuestas. Debido al efecto sobre la luz polarizada se dice que los enantiómeros son compuestos óptimamente activos.
Para comprender este comportamiento de los enantiómeros es necesario entender la naturaleza de la luz polarizada plana. También es necesario comprender cómo opera un instrumento llamado polarímetro.
11. 11. ¿Cómo se refleja en la nomenclatura de
las moléculas quirales o asimétricos, su diferente comportamiento frente a la
luz polarizada?R:la quiralidad es un parámetro inherente a la organización esencial subyacente en toda forma de vida.
Muchas moléculas no asociadas con la vida también exhiben quiralidad. Pero cuando los organismos se reproducen, sus vástagos poseen moléculas quirales que tienen la misma quiralidad que las moléculas presentes en el cuerpo de sus padres. A medida que la vida se expanda en un planeta, aumentará en éste la presencia de moléculas de una quiralidad particular, en detrimento de las otras.
12. 12.Los monosacáridos se agrupan en dos
grandes clases, las series D y L. ¿Cómo se determina la pertenencia de un
monosacárido a la serie D ó L?R:Los isómeros ópticos poseen entre sí mismo número y la misma clase de carbonos, pero se diferencian por su organización espacial. Además poseen la propiedadad de desviar la luz polarizada hacia la derecha (D ) - moléculas dextrógiras o hacia la izquierda ( L ) - moléculas levógiras.
Se asigna la letra D a la estructura configuracional y L a su enantiomero
13. ¿Qué son monosacáridos epímeros?R:Los monosacáridos o azúcares simples son los glúcidos más sencillos, que no se hidrolizan, es decir, que no se descomponen para dar otros compuestos, conteniendo de tres a seis átomos de carbono. Su fórmula empírica es (CH2O)n donde n ≥ 3. Se nombran haciendo referencia al número de carbonos (3-7), terminado en el sufijo -osa. La cadena carbonada de los monosacáridos no está ramificada y todos los átomos de carbono menos uno contienen un grupo alcohol (-OH). El átomo de carbono restante tiene unido un grupo carbonilo (C=O). Si este grupo carbonilo está en el extremo de la cadena se trata de un grupo aldeído (-CHO) y el monosacárido recibe el nombre de aldosa. Si el carbono carbonílico está en cualquier otra posición, se trata de una cetona (-CO-) y el monosacárido recibe el nombre de cetosa.Epímeros: dos monosacáridos que se diferencian en la configuración de uno solo de sus carbonos asimétricos.Por ejemplo la D-Glucosa y la D-Manosa sólo se diferencian en la configuración del hidroxilo en el C2
14. ¿Qué son estereoisómeros?R:Estereoisómeros Son sustancias cuyas moléculas tienen el mismo número y tipo de átomos ubicados en el mismo orden, diferenciándose únicamente en el arreglo espacial de sus átomos. Introducción La química es sin duda una ciencia molecular. Los fenómenos químicos y físicos observables se explican convenientemente en términos de la estructura molecular y aquí juega un papel importante el estudio de los estereoisómeros.
15. ¿Qué es un enlace hemiacetálico?R:La formación del ciclo se realiza mediante un enlace hemiacetal, que supone un enlace covalente entre el grupo aldehído y un alcohol( en caso de las aldosas), o un enlace hemicetal entre el grupo cetona y un alcohol( en el caso de las cetosas). Este enlace no implica pérdida ni ganancia de átomos, sino una reorganización de los mismos.
El ciclo resultante puede tener forma pentagonal (furano) o hexagonal (pirano), denominandose los monosacáridos furanosas opiranosas respectivamente.
* El carbono carbonílico correspondiente a los grupos aldehído y cetona se designa en la fórmula cíclicoa con el nombre de carbono anomérico, y queda unido a un grupo -OH.
* La posición del grupo -OH unido al carbono anomérico determina un nuevo tipo de estereoisomeria conocido como anomería.
17. ¿Cómo se obtienen los ácidos
glucónicos a partir de la glucosa?R:La principal enzima involucrada en la oxidación de la d-D-glucosa es la comúnmente
llamada glucosa oxidasa. Esta enzima es una flavoproteína que remueve dos
hidrógenos de la glucosa reduciéndose. La forma reducida de la enzima luego se
reoxida con oxígeno molecular dando agua oxigenada que es luego hidrolizada por
una catalasa. La ecuación neta se puede escribir
D -Glu cosa + 0.5 O2 ¾® Acido D -Gluconico + H2O
Se ha demostrado para A. níger que tanto la glucosa oxidasa como la catalasa se
encuentran en peroxisomas evitándose de esta forma la toxicidad por H202
.El último paso en la obtención de glucónico es la hidrólisis de la d-lactona. Esta puede
ocurrir espontáneamente o por intermedio de una lactonasa (que se halla presente en
A. níger). La acumulación de la lactona reprime la producción de glucónico. La
hidrólisis de la lactona ocurre espontáneamente a alta velocidad a pH neutro o
alcalino. A pH ácidos es importante la actividad de la lactonasa.
El pH también es importante para favorecer la ruta metabólica que lleva a la
producción de glucónico, ya que a valores de éste neutros o alcalinos A. níger produce
este ácido casi exclusivamente. Además, a valores de pH entre 1 y 3, el glucónico es
rápidamente metabolizado por A. níger.
18. ¿Cuáles son los ésteres más
importantes de los monosacáridos?R:Derivados de los monosacáridos
A los grupos hidroxilos de los monosacáridos se le pueden unir a otros
grupos funcionales, los más importantes y que desempeñan una función biológica
son :
a) Esteres de fosfato.
Un grupo fosfórico se une a un grupo hidroxilo formando un éster fosfato,
ejemplo de esto es el D-Gliceraldehído-3-fosfato o la a-D-glucosa -6-fosfato. Los
azúcares fosfato son intermediarios importantes del metabolismo y actúan como
compuestos activados en el anabolismo.
b) Ácidos y lactonas.
Estos se producen en presencia de un agente oxidante, formando ácidos
aldónicos. Algunos de ellos son el ácido D-glucónico, la d-gluconolactona.
c) Alditoles.
Estos se producen al reducirse el grupo carbonilo del azúcar, en la
naturaleza se encuentran el eritrol, el D-manitol y el D-glucitol, también conocido
como sorbitol.
d) Aminoazúcares.
En estos un grupo amino se une al azúcar, la glucosamina y la
galactosamina son los más frecuentes. De la glucosamina proceden otros como el
ácido murámico y el ácido N-acetilmurámico.
19. 19. ¿Qué productos se obtienen de la
reducción fisiológica de los monosacáridos? Citar algunos ejemplos. R:Cuando cristaliza la glucosa se obtienen cristales de solamente una de ellas, dependiendo de las condiciones, ya que las moléculas son demasiado distintas para que puedan cristalizar juntas. Normalmente se obtiene la a-glucosa, monohidratada o anhidra. Cuando la a-glucosa se disuelve, comienza inmediatamente a producirse el paso a la forma b, hasta que se alcanza en equilibrio. En este proceso se observa la llamada "mutarrotación", el cambio del valor del desvío del ploano de giro de la luz polarizada desde el correspondiente a la a-glucosa hasta el correspondiente al equilibrio. El establecimiento del equilibrio depende de la temperatura, y a temperaturas bajas puede lleva muchos minutos.
La glucosa es un azúcar muy importante desde el punto de vista industrial. Aunque se encuentra presente de forma natural en las frutas, la glucosa se obtiene por hidrólisis enzimática del almidón, obtenido a su vez del maíz o de otros cereales, dependiendo del precio del cereal y del valor de los otros productos que se obtengan, como el gluten en el caso de utilizarse el trigo. Se comercializa generalmente disuelta en forma de jarabe o cristalizada como el monohidrato.
En su comercialización, se utiliza con frecuencia el nombre antiguo de "dextrosa", que hace referencia a que es dextrógira, es decir desvía hacia la derecha el plano de giro de la luz polarizada. El término "equivalente de dextrosa", DE, con el que se expresa la concentración de estos jarabes no es exactamente el contenido de glucosa, sino el poder reductor considerando que todo el carbohidrato presente fuera glucosa. Es decir, el "equivalente de dextrosa" de un jarabe es el contenido de glucosa, más 1/2 del contenido de maltosa, mas 1/3 del contenido de maltotriosa, etc.
20. ¿Qué tipo de enlace forman los
oligosacáridos y que nombre recibe? ¿Cómo se forma?R:
Los oligosacáridos son polímeros de hasta 20 unidades de monosacáridos. La unión de los monosacáridos tiene lugar mediante enlaces glicosídicos, un tipo concreto de enlace acetálico. Los más abundantes son los disacáridos, oligosacáridos formados por dos monosacáridos, iguales o distintos. Los disacáridos pueden seguir uniéndose a otros monosacáridos por medio de enlaces glicosídicos:
- si el disacárido es reductor, se unirá a otros monosacáridos por medio del OH de su carbono anomérico o de cualquier OH alcohólico
- si no es reductor, se unirá únicamente por medio de grupos OH alcohólicos
Así se forman los trisacáridos, tetrasacáridos, o en general,oligosacáridos. La cadena de oligosacáridos no tiene que ser necesariamente lineal, y de hecho, con mucha frecuencia se encuentran en la Naturaleza oligosacáridos y polisacáridos ramificados.
Se ha establecido arbitrariamente un límite de 20 unidades para definir a los oligosacáridos. Por encima de este valor se habla de polisacáridos. |
 Los oligosacáridos suelen estar unidos covalentemente a proteínas o a lípidos formando glicoproteínas yglicolípidos.
Los oligosacáridos pueden unirse a las proteínas de dos formas:
Los oligosacáridos suelen estar unidos covalentemente a proteínas o a lípidos formando glicoproteínas yglicolípidos.
Los oligosacáridos pueden unirse a las proteínas de dos formas:
- mediante un enlace N-glicosídico a un grupo amida de la cadena lateral del aminoácido asparagina
- mediante un enlace O-glicosídico a un grupo OH de la cadena lateral de los aminoácidos serina o treonina.